К.Н. Сорокина¹, М.А. Уфимцева¹, Н.В. Симонова¹, Т.А. Береснева², П.В. Паскевич¹
¹Федеральное государственное бюджетное образовательное учреждение высшего образования «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО УГМУ Минздрава России);
²Федеральное бюджетное учреждение науки «Екатеринбургского медицинского научного центра профилактики и охраны здоровья рабочих промпредприятий» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, г. Екатеринбург, Россия
РЕЗЮМЕ
Актуальность. Акне - социально значимое дерматовенерологическое заболевание с высокой распространенностью среди детского и взрослого населения. В результате разрешения воспалительных элементов формируется симптомокомплекс постакне, в ряде случаев завершающийся неблагоприятнымисходом с формированием рубцовых деформаций.
Цель исследования. Изучение эффективности и безопасности применения ферментного геля Карипаин Scar в терапии атрофических рубцов постакне.
Материалы и методы. Клиническое продольное неконтролируемое исследование (before-after study) с включением 22 пациентов, имеющих акне в анамнезе и поствоспалительные симптомы постакне. Пациенты наружно использовали гель с аквакомплексом глицеросольвата титана, коллагеназой и папаином 2 раза в день на участки кожи лица с атрофическими рубцами на протяжении 3 месяцев с ежемесячными контрольными осмотрами. Оценку эффективности терапии проводили после 3 месяцев применения препарата (с помощью оценочных шкал G.J. Goodman и Manchester Scar Scale). Оценка влияния симпомокомплекса постакне на качество жизни пациентов изучали с помощью использования дерматологического индекса качества жизни (DLQI).
Результаты. В ходе исследования применения ферментного препарата обнаружены статистически значимые различия при оценке степени выраженности рубцов (G.J. Goodman, p<0,05) и оценке клинико-функциональных параметров (Manchester Scar Scale, p<0,05). После окончания терапии в результате опроса пациентов установлено улучшение качества жизни пациентов (DLQI p<0,001).
Заключение. В терапии атрофических рубцов постакне гель Карипаин scar показал выраженную эффективность и безопасность применения.
Ключевые слова: акне, симптомокомплекс постакне, атрофические рубцы, коллагеназа, терапия.
ABSTRACT
Background. Acne is a socially significant dermatological disease with a high prevalence among children and adults with the formation of a pronounced post-acne symptom complex with the most severe consequences, such as scarring.
Objective. Studying the efficacy and safety of the use of the enzyme gel Karipain Scar in the treatment of post-acne atrophic scars.
Materials and methods. A clinical longitudinal uncontrolled study (before-after study) with the inclusion of 22 patients with a history of acne and post-inflammatory symptoms of post-acne. Patients externally used a gel with an aquacomplex of titanium glycerosolvate, collagenase and papain 2 times a day on facial skin areas with atrophic scars for 3 months with monthly control examinations.
Evaluation of the effectiveness of therapy was carried out after 3 months of using the drug (collection of complaints and examination of the skin, photographing, assessment of symptoms of the disease using the Goodman scale, Manchester Scale).
Assessment of the effect of the post-acne symptom complex on the quality of life of patients was studied using the use of DLQI.
Results. During the study of the use of the enzyme preparation, statistically significant differences were found in the assessment of the severity of scars (Goodman <0.05) and the assessment of clinical and functional parameters (Manchester School p<0.05). After the end of therapy, the patients' IQ decreased by 2 times.
Conclusion. In atrophic scars after acne, the gel Karipain scar showed pronounced efficacy and safety of use.
Key words: acne, post-acne symptom complex, atrophic scars, collagenase, therapy.
Введение.
Акне (acne vulgaris, вульгарные угри) – генетически опосредованное хроническое заболевание сально-волосяных фолликулов, в результате разрешения которого формируются постакне на открытых участках кожи, что негативно влияет на качество жизни пациентов и снижает психосоциальную адаптацию [36]. В структуре общей заболеваемости акне занимает восьмое место в мире и встречается у 3,9% - 9,4% населения, среди дерматологической патологии вульгарные угри наблюдаются у 22,0% - 32,0% пациентов [22, 23, 24]. В возрасте до 25 лет у 45% молодых людей и у 85% подростков диагностировано акне различной степени выраженности. Заболеваемость среди подростков в Российской Федерации составляет 65,0% - 93,3% [1, 39, 40].
Международным альянсом по лечению акне в 2009 году было предложено объединить под термином «симатомокомплекс постакне» следующие явления: рубцовые деформации кожи, застойную эритему, поствоспалительную де- и гиперпигментацию [2, 3]. Формирование рубцов атрофических, гипертрофических или келоидных является наиболее тяжелыми последствиями акне. В следствие формирования устойчивых косметических дефектов на лице и открытых участках кожи в 10 – 40% случаев постакне оказывает влияние на социальное и психологическое функционированиечеловека, способствует развитию тревожно-депрессивных и психопатологических расстройств, снижению самооценки, склонности к суициду [4, 5].
Клинические варианты течения акне и постакне зависят от морфофизиологических особенностей кожи, фототипа и национальной принадлежности пациента, имеют генетическую предрасположенность. При отягощенной наследственности со стороны обоих родителей, имеющих в анамнезе акне, частота возникновения угревых элементов у ребенка в 2 раза выше и наиболее часто акне протекает в тяжелой форме. У пациентов со светлым фототипом (I–III фототип по Фицпатрику) воспалительные явления на коже менее выражены, по сравнению с пациентами, обладающими более темным фототипом кожи (IV–VI фототип по Фицпатрику), у которых чаще наблюдается поствоспалительная гиперпигментация, комедональное акне и склонность к формированию келоидных и гипертрофические рубцов [26, 27].
Holland D. B. и Jeremy A. H. в своем исследовании отметили, что причина развития рубцов у определенных пациентов основывается на роли характера воспалительного ответа. Иммуногистохимические образцы воспалительных элементов акне в острую стадию у пациентов, которые не были склонны к образованию рубцов постакне, продемонстрировали активный неспецифический иммунный ответ, который сопровождался выраженным ангиогенезом, экспрессией молекул сосудистой адгезии с преимущественным привлечением большого количества CD4+ Т-клеток и притоком макрофагов, клеток Лангерганса и высокой клеточной экспрессией HLA-DR (human leukocyte antigens, человеческие лейкоцитарные антигены). Количество клеток достигало максимума через 48 часов от начала воспаления, далее происходило снижение количества лейкоцитов, молекул сосудистой адгезии в длительно существующих воспалительных элементах. Напротив, пациенты, склонные к образованию рубцов постакне, имели менее активный специфический иммунный ответ в свежих воспалительных элементах, который увеличивался при разрешении поражений. Уровень клеточной экспрессии HLA-DR при ранних поражениях был низким, что указывало на инактивированный и неэффективный ответ. Кроме того, количество CD4+ Т-клеток в инфильтрате было меньшим, но стабильным, без снижения количества клеток в более старых поражениях в фазе репарации. Наблюдалась повышенная регуляция клеточного ответа с дальнейшим увеличением количества макрофагов и эффекторных клеток памяти кожи с усилением клеточной активации, способствующей тканевой бактериальной антигенной деградации. Сохранялся высокий уровень ангиогенеза, что способствовало длительной воспалительной реакции. Таким образом, авторы сделали вывод, что процесс рубцевания - хроническая реакция гиперчувствительности замедленного типа (IV типа), спровоцированная стойким антигенным стимулом [41, 42]. Макрофаги поддерживают активность Т-клеток, их присутствие составляет доминирующую силу в имунном ответе.
Лимфоциты и макрофаги секретируют широкий спектр цитокинов и факторов роста, которые, как известно, модулируют пролиферацию и фенотип фибробластов кожи: IL-1, трансформирующий фактор роста-β, тромбоцитарный фактор роста, обладающие фиброгенным действием - IL-4, IL-6, оказывающие антифиброгенное действие - IL-2, ФНО-α и IFN-γ. В процессе заживления ран существует четкий баланс между про- и антифибриногенными цитокинами и факторами роста. Дисбаланс между ними способствует нарушению синтеза белка внеклеточного матрикса и влияет на функции фибробластов, такие как ремоделирование и сокращение раны, которые являются факторами, способствующими образованию рубцов [6, 7].
В исследовании Moon J., Yoon J. были выявлены гистологические изменения и специфические молекулы, контролирующие весь ход образования атрофического рубца. Атрофические рубцы содержат меньше эластичных волокон, увеличенное количество неправильных, истонченных волокон, чем нормальная кожа. Недостаток эластичных волокон сохраняется с самого начала появления воспалительных элементов акне [19]. В более ранних исследованиях авторы описывали, что искаженное соотношение коллагена I типа к коллагену III типа, а также количество коллагеновых волокон могут влиять на ненормальную организацию экстрацеллюлярного матрикса (ЭЦМ), что приводит к изменению эластичности и структуры кожи [8].
Результаты исследования Midgley A., Rogers M. указывают на сильное разрушение как коллагена I типа, так и III типа, но увеличенное соотношение коллагена I типа к коллагену III типа у пациентов со склонностью к образованию рубцов подразумевает, что деградация коллагена III типа происходит легче. Кроме того, повышенный уровень TGF-β1, который способствует компенсаторному восстановлению коллагена I типа больше, чем вовлеченного в этот процесс коллагена III типа [8, 19]. Следовательно, заметное разрушение и несбалансированный метаболизм компонентов ЭЦМ во время возникновения воспалительных элементов могут быть основными причинами атрофического рубцевания. Чрезмерное разрушение эластических волокон и коллагеновых волокон, агрессивное воспаление, опосредованное врожденным иммунитетом и клетками Th17 и Th1, снижение пролиферации кератиноцитов и передача сигналов TGF-β1 (transforming growth factor β, TGF-β) служат центром, модулирующим патологический процесс перехода воспалительных элементов акне в атрофические рубцы. TGF-β3 является хемоаттрактантом для нейтрофилов и макрофагов, индуцирует рост грануляционной ткани и ангиогенез, стимулирует синтез ЭЦМ и ингибирует его деградацию, избыток TGF-β1 и TGF-β2 приводит к образованию фиброза.
Пептидогликан клеточной стенки С.acnes играет важную роль в процессе образования рубцов постакне, который с помощью генной экспрессии синтеза proMMP-2 усиливает деградацию ЭЦМ [9]. ММP-1 - основная протеаза, которая является медиатором деградации коллагеновых фибрилл I-го и III-го типа и других компонентов ЭЦМ (эластин, протеогликаны, ламинин), вызывает агрегацию фрагментированного коллагена. Фибробласты, себоциты и кератиноциты синтезируют множество ферментов, в том числе отвечающих за строение внеклеточного матрикса металлопротеиназ (MMPs) и тканевых ингибиторов металлопротеиназ (TIMPs). Активность MMPs (MMP-1, 2, 9, 13, pro MMP-1, 2, 9) приводит к разрушению большинства компонентов внеклеточного вещества: интерстициального коллагена и коллагена базальной мембраны, протеогликанов, декорина, фибромодулина, фибронектина. ММPs опосредованно участвуют в морфогенезе, ангиогенезе, пролиферации, миграции, дифференцировке, апоптозе клеток, в межклеточных и клеточно- матриксных взаимодействиях, так как точкой приложения их действия являются факторы роста и их рецепторы, цитокины, интегрины, факторы апоптоза. Дисбаланс между MMPs и TIMPs приводит к образованию атрофических или гипертрофических рубцов [30, 32].
В основе классификации рубцов постакне лежит реакция тканей на воспаление: с нормальным формированием рубцовой ткани - норматрофические рубцы, с избыточным формированием рубцовой ткани - келоидные и гипертрофические рубцы или с недостаточным формированием рубцовой ткани - атрофические рубцы, которые встречаются в 80–90% случаев.
По данным Lauermann F.T. et al. (2016 г.) рубцы постакне в 80% случаев локализуются в щечной области. В зависимости от глубины поражения и формы атрофического рубца Jacob D. и соавт. (2001г.) в своей работе по разработке классификации рубцов постакне предложили разделить их на 3 подтипа: V-образные (Icepick), U-образные (Boxcar), M-образные (Rolling) с различной степенью тяжести от легкой до тяжелой [31]. Согласно классификации Карабут М.М. (2016г.) атрофические рубцы постакне подразделяются на глубокие и поверхностные, узкие и широкие, ямкообразные, сколотые, волнистые, блюдцеобразные, кратерообразные [28].
В настоящее время для коррекции атрофических рубцов постакне применяют аппаратные методики: неабляционную и абляционную лазерную обработку кожи, фракционное радиоволновое воздействие, фототерапию; инъекционные методики: микронидлинг, субцизию, дермальные филлеры, PRP-терапию, инъекционное введение аутологичной культуры фибробластов, мезотерапию; хемоэксфолиацию, микродермабразию; физиотерапевтические методики: лекарственный форез, ультразвуковая терапия; наружную терапию применением средств, содержащих ферменты, экстракты растений, кислот и другие активные компоненты [16, 17, 18, 19, 20].
Современные косметологические методики, такие как хемоэксфолиация, лазерные технологии и инъекции относятся к болезненным и дорогостоящим процедурам, которые обладают разным по продолжительности реабилитационным периодом, большинство из них не предусмотрены для выполнения в подростковом возрасте до 18 лет. В связи с чем, разработка новых доступных средств для лечения постакне с применением, в том числе детской практике, остается актуальной проблемой.
Цель исследования - изучение эффективности и безопасности применения ферментного геля Карипаин Scar в терапии атрофических рубцов постакне.
Материалы и методы:
Проведено клиническое продольное неконтролируемое исследование (before-after study), в которое вошли 22 пациента, среди них 18 (81,8%) женщин и 4 (18,2%) мужчин (средний возраст 21,5 ± 2,3 года) с диагностированным акне в анамнезе и с симптомами постакне (эритема, пигментация, атрофические рубцы). У всех пациентов в анамнезе было диагностировано акне средней и тяжелой степени тяжести, в связи с чем они получали топическую терапию (адапален, бензоил пероксид, антибактериальные препараты) или системную терапию (изотретиноин, антибиотикотерапию) в разные возрастные периоды их жизни. Критерии включения: пациенты старше 18 лет, не получающие на момент проведения исследования наружную и системную терапию по лечению акне, пациенты с наличием постакне - свежих атрофических рубцов с длительностью существования на коже не более 6 месяцев, пациенты, не имеющие аллергические реакции и аллергические заболевания в течение жизни. Критерии исключения: отказ подписывать информированное согласие, пациенты с соматическими заболеваниями в стадии декомпенсации, возраст младше 18 лет.
С целью коррекции выраженности атрофических рубцов постакне пациенты использовали наружно гель с аквакомплексом глицеросольвата титана, коллагеназой и папаином (Карипаин Scar ГОСТ 31695-2012 ТР ТС 009/2011) 2 раза в день на участки кожи лица с атрофическими рубцами на протяжении 3 месяцев с ежемесячным осмотром в промежутке исследования на первом и втором месяце применения препарата. Во время всего курса лечения все пациенты для очищения и увлажнения кожи использовали средства лечебной косметики без наличия в составе кислот, экстракта гамомелиса, ретиноидов, ниацинамида и других активных компонентов, которые могли повлиять на результат исследования.
Оценку эффективности лечения рубцов постакне осуществляли с использованием международной качественной шкалы по Гудману (A Qualitative Global Scarring Grading System, Goodman G.J., 2006), которая включает 4 степени выраженности рубцов постакне: макулярный, слабый, средний и выраженный; Манчестерской шкалы оценки рубцовых деформаций (Manchester Scar Scale — MSS), позволяющей осуществлять оценку рубцов по 5 показателям: плотность, цвет, текстура, рельеф, смещение окружающих тканей (чем более выражены изменения, тем выше балл) [37, 38].
Влияние постакне на различные сферы жизни оценивалась с помощью опросника «Дерматологический Индекс Качества Жизни (ДИКЖ, The Dermatology Life Quality Index (DLQI)), который рассчитывался путем суммирования баллов: значения «немного/редко» – 1 балл, «сильно/часто» – 2 балла, «очень сильно/очень часто» – 3 балла. Максимальное значение индекса равно 30 баллов, минимальное значение – 0 баллов. Интерпретация индекса: 0-1 балл – заболевание не оказывает влияния на качество жизни пациента, 2-5 балла – оказывает незначительное влияние, 6-10 – умеренное влияние, 11-20 – сильное влияние, 21-30 чрезмерное влияние [44].
Контрольной точкой изучения эффективности терапии считали окончание лечения (третий месяц).
Статистическая обработка проводилась с помощью ПО Exel и Gretl с расчетом двухвыборочного теста для средних и знаково-рангового теста Вилкоксона.
Результаты.
В ходе клинического исследования все пациенты получали наружную терапию атрофических рубцов постакне оригинальным комбинированным препаратом Карипаин Scar гель («НПК Карипаин»), в состав которого входят ферменты коллагеназа и папаин, нейроуспокаивающий экстракт, транскутанный проводник - аквакомплекс глицеросольвата титана.
Основной механизм терапевтического действия коллагеназ - способность превращать с помощью гидролиза пептидных связей нативный нерастворимый коллаген в растворимую форму [10]. Истинные коллагеназы (класс MMPs), расщепляют тройную спираль коллагена в одной специфической точке, образуя растворимые крупные фрагменты, дальнейшее разрушение которых протекает более медленно [11]. Эффективность коллагеназ в терапии рубцов связывают с их способностью к гидролизу избыточного коллагена [12]. Выявлена тенденция к увеличению содержания влаги в ткани рубца, которую Майорова А.В. и Сысуев Б.Б. в своем исследовании связали с увеличением фракции внутриклеточной структурированной воды. Установлено, что гидратация рубцовой ткани при воздействии коллагеназы приближалась к величинам, свойственным здоровой коже аналогичной локализации [13]. Li Z.J. и Kim S.M определили способность коллагеназы влиять на сокращение коллагенового геля, активность матриксных металлопротеиназ (ММP), высвобождение гидроксипролина и уровень активности генов фибробластов, а также увеличивать активность ММP-2 и ММP-9, что проявлялось в виде высвобождения большого количества гидроксипролина. Обработка культуры клеток фибробластов коллагеназой значительно снижала пролиферацию фиброцитов в 3 дневных культурах. Установлена способность коллагеназы влиять на экспрессию генов, контролирующих воспалительную реакцию в фибробластах [14].
Аквакомплекс глицеросольвата титана (АГТ) 100% - органическое металлокомплексное соединение. Атом титан, входящий в состав геля, относится к микроэлементам, необходимым для построения эпителиальной ткани, для ускорения синтеза гемоглобина, процессов иммуногенеза, эритропоэза, спинномозговой жидкости, для различных отделов головного мозга, для формирования костной мозоли при переломах. Благодаря своей структуре, аквакомплекс обладает микробиологической чистотой, стерильностью, противовоспалительным, антимикробным действием, уменьшает воспалительные явления, обеспечивает протекторное и дегидратирующее (противоотечное), местное анальгезирующее действия, обладает высокой проникающей способностью через барьеры кожи и слизистых оболочек и выполняет роль технологической платформы для доставки ферментов в глубокие слои рубцовой ткани. При этом современные исследования (ИК-спектроскопия, УФ-спектрофотометрия и т.д.) подтвердили способность АГТ стабилизировать растворенные в нем препараты благодаря его способности взаимодействовать с биологически активными веществами различной природы, не разрушая их структуру, а мягко облегая в свою гелевую систему за счет образования с ними стабильных комплексов. Образование комплексов АГТ с биологически активными веществами подтверждает факт иммобилизации препаратов посредством водородных и координационных связей на органическом металлокомплексном гелевом носителе АГТ. Это способствует повышению терапевтической активности иммобилизованных препаратов. Так, проведенные с помощью сканирующего зондового микроскопа SolverPro-M (NT-MPT) исследования влияния АГТ на ферменты фитопаин и папаин показали, что при введении в АГТ водного раствора фермента образуется глобулярная структура конгломерата фермент – АГТ, в результате чего активность ферментов не только сохраняется, но и увеличивается на 10-15%.
При наружном применении АГТ быстро всасывается и распределяется в коже, подкожной клетчатке и прилежащих тканях, не накапливает жидкость в тканях, предохраняет их от высыхания, усиливает оксигенацию. В организме не накапливается, выводится в течение 20-24 часов в неизменном виде почками (42%), через кишечник (48%), потовыми железами (6,2%), через слизистые оболочки дыхательных путей (3,8%).
Второй ферментный компонент в составе препарата папаин - цистеиновая протеаза, выделенная из молока незрелой папайи (Carieapapaya), обладающая высокой ферментативной активностью, хорошей термостабильностью, безопасностью. Протеолитический фермент предотвращает образование гипертрофических рубцов во время заживления ран, воздействуя на многие типы клеток, которые участвуют в регенерации тканей. Папаин обладает противовоспалительным, антибактериальным, антиоксидантным эффектом, воздействует на деградацию коллагена и белков. Ангиогенный эффект эндотелия сосудов, активируемый фактором роста эндотелия сосудов (VEGF), ингибируется папаином путем вмешательства его в процесс фосфорилирования. Папаин способен разрушать белки плотных соединений (ZO-1, клаудин-4, окклюдин) в кератиноцитах человека и значительно снижать экспрессию TGF-β1 и фосфорилирование Smad (семейство структурно сходных белков, которые являются основными передатчиками сигналов для рецепторов суперсемейства TGF-β), тем самым эффективно регулируя клеточную пролиферацию, действие клеток и внеклеточного матрикса путем регуляции сигнального пути TGF-β/Smad, снижая выработку коллагена и кератиновой ткани, расположенной в дерме. По сравнению с нормальной кожей, высокая экспрессия белка NF-κB p65 в рубцовой ткани приводит к аномальной пролиферации фибробластов, избыточному синтезу коллагена и аномальному накоплению внеклеточного матрикса. Доказано, что папаин значительно снижает экспрессию белка NF-κB p65 в процессе рубцевания. Таким образом, регулируя сигнальный путь NF-κB папаин способствует профилактике и лечению гипертрофических рубцов [34, 35].
Уникальный нейроуспокаивающий концентрат “Нейрофенс”, получаемый из корней красного шалфея, богатого фенолами и сальвианолевой кислотой, ограничивает гиперреактивность сенсорных нервных волокон кожи, защищает кожу от воздействия экспозом-факторов, что делает возможным применение препарата у пациентов с чувствительной и раздраженной кожей. Ферментный препарат Кaрипаин scar обладает двойным эффектом: реструктуризирует рубцовую ткань, подавляет гиперплазию и ингибирует воспалительный процесс.
Сочетание в одном препарате нескольких ингредиентов с однонаправленным действием обусловливает плейотропные фармакологические свойства и позволяет воздействовать на несколько звеньев патогенеза образования рубцовых деформаций, что может приводить к достижению быстрых клинических результатов и высокой эффективности терапии.
Контроль эффективности применения геля Карипаин Scar у пациентов с атрофическими рубцами постакне проводили через 3 месяца после начала использования с промежуточными осмотрами в конце первого и второго месяцев применения для оценки переносимости терапии. При субъективной оценке ощущений во время и после применения препарата пациенты отметили, что Карипаин Scar был комфортен в применении, полностью впитывался и не оставлял ощущение липкости и усиления выработки себума на коже лица.
Побочных эффектов в виде эритемы, жжения, аллергических реакций зарегистрировано не было на протяжении всего курса терапии.
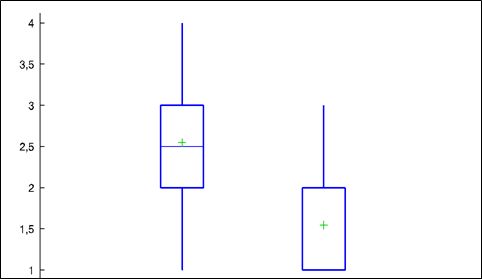
В ходе исследования оценку степени выраженности атрофических рубцов постакне у пациентов проводили с применением международной качественной шкалы Goodman G.J. et al. (2006). Средние значение степени выраженности рубцов до начала терапии ферментным гелем составило 2,5 (ДИ 95%: от 2,2 до 2,8), после завершения наружной терапии – 1,5 (ДИ 95%: от 1,2 до 1,8) (рис. 1).
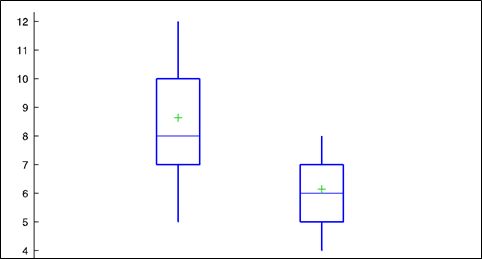
Структурные характеристики рубцовых деформаций в данном клиническом исследовании анализировали в соответствии с Манчестерской шкалой оценки рубцов (Manchester Scar Scale, MSS, 1998). При динамическом наблюдении изменений цвета, текстуры, рельефа, плотности рубцов и смещения относительно окружающих тканей установлено снижение показателя среднего значения балльной оценки рубцов до старта терапии с 8,6 (ДИ 95%: от 2,2 до 2,8) до среднего значения 6,1 (ДИ 95%: от 1,2 до 1,8) по окончании топического лечения (рис. 2). Все пациенты после курса применения геля с коллагеназой отмечали сглаживание рельефа кожи при пальпации, уменьшение плотности рубцовых деформаций и их визуализации, изменение цвета рубца, что позволило 18,1% пациентов отказаться от ежедневного применения маскировочных средств (рис. 3, 4). Для оценки влияния симптомокомплекса постакне на различные аспекты жизни пациентов, а также оценки эффективности курса наружной терапии рубцовых изменений кожи, пациенты проходили скрининговое тестирование с помощью опросника «Дерматологический Индекс Качества Жизни» (DLQI). Опросник заполнялся всеми пациентами самостоятельно до начала лечения и после окончания терапии, анонимно, только с указанием пола пациента. В результате анкетирования было установлено, что у 13 (59,0%) пациентов проявления постакне оказывали умеренное влияние на качество жизни (значение индекса 11-20), для 2 (9,1%) женщин поствоспалительные изменения со стороны кожи были оценены как чрезвычайно сильное влияние (значение индекса в диапазоне – 21-30), 5 (22,7%) пациентов указали на незначительное влияние (значение индекса 2-5). После проведения трехмесячной терапии атрофических рубцов постакне с помощью ферментного препарата только 2 (9,1%) пациента отмечали умеренное влияние на качество жизни, остальные отметили отсутствие или незначительное влияние – 5 (22,7%) и 14 (63,6%) пациентов соответственно. При статистической обработке данных среднее значение ДИКЖ (DLQI) до лечения составило 6,8 (ДИ 95%: от 5,5 до 8,0), после лечения – 3,0 (ДИ 95% от 2,0 до 4,1) (р<0,001).
Заключение.
В результате проведенного исследования было установлено, что применение геля Карипаин Scar в наружной терапии атрофических рубцов в течение 3 месяцев оказало выраженное ремоделирующее действие, что привело к снижению степени выраженности, изменению цвета, плотности и, соответственно, визуализации рубцов постакне (оценка рубцов по шкале G.J. Goodman (р<0,05), оценка по Манчестерской шкале (р<0,05)). Минимизация клинических проявлений атрофических рубцов постакне способствовала повышению качества жизни пациентов и их социальной адаптации (ДИКЖ (DLQI) р<0,001). Исследуемый препарат обладает высокой безопасностью, что подтверждается отсутствием побочных эффектов, и возможностью применения в детской практике (разрешено применение с 12 лет). Ферментный гель Карипаин Scar может применяться в виде монотерапии, так и на этапе подготовки или в сочетании с другими методами лечения рубцовых деформаций кожи.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи. The authors declare the absence of obvious and potential conflicts of interest related to the publication of this article.
 До лечения / После лечения
До лечения / После лечения
Рисунок 1. Распределение смещения показателей шкалы G.J. Goodman et al. (2006 г.) до и после наружной терапии (p<0,05)
Figure 1. Distribution of the displacement of the scale indicators G.J. Goodman et al. (2006) before and after therapy (p<0.05).
До лечения / После лечения
Рисунок 2. Распределение смещения показателей Манчестерской шкалы до и после терапии (p<0,05).
Figure 2. Distribution of the bias of Manchester School indicators before and after therapy (p<0.05).
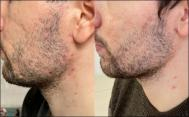
Рисунок 3 а,б. Пациент, 24 года, атрофические рубцы постакне до и после применения наружной терапии (Карипаин Scar).
Figure 3 a,b. The male patient 24-year-old. Before the start of the course and after the use of the drug Karipain Scar for 3 months.
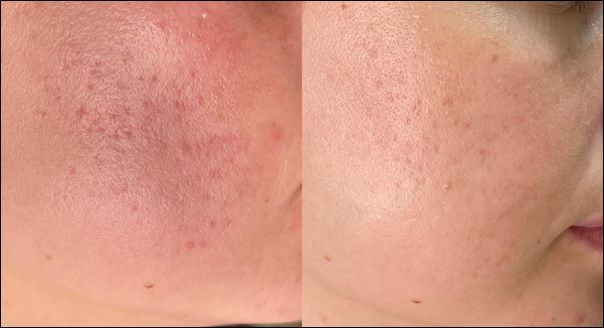
Рисунок 4 а,б. Пациентка, 25 лет, атрофические рубцы постакне – результат применения геля Карипаин Scar в течение 3 месяцев.
Figure 4 a,b. The female patient 25-year-old. Before the start of the course and after the use of the drug Karipain Scar for 3 months.
Литература /References
- Lynn D.D, Umari T., Dunnick C.A., Dellavalle R.P. The epidemiology of acne vulgaris in late adolescence. Adolesc. Health Med. Ther. 2016; 7: 13–25. DOI: 10.2147/AHMT. С55832.
- Layton A.M., Henderson C.A., Cunliffe W.J. A clinical evaluation of acne scarring and its incidence. Clin Exp Dermatol. 1994; 19(4): 303–308. DOI: 10.1111/j.1365-2230.1994.tb01200.x.
- Thiboutot D.M, Gollnick H.P.M., Bettoli V., Dréno B., Kang S. New insights into the management of acne: An update from the Global Alliance to Improve Out-comes in Acne Group. J. Am. Acad. Dermatol. 2009; 60(5): 1-50. DOI: 10.1016/j.jaad.2009.01.019.
- Симонова Н.В., Уфимцева М.А., Сорокина К.Н., Жунисова Д.С., Мыльникова Е.С. Современные лазерные технологии в коррекции атрофиеских рубцов постакне. Вестник Уральского государственного медицинского университета. 2021; 4(55): 46-49.
- Hayashi N., Miyachi Y., Kawashima M.. Prevalence of scars and ‘mini- scars’, and their impact on quality of life in Japanese patients with acne. J Dermatol. 2015; 42: 690–6. DOI: 10.1111/1346-8138.12885
- Holland D.B., Jeremy A.H.T., Roberts S.G., Seukeran D.C., Layton A.M., Cunliffe W.J. Inflammation in acne scarring: a comparison of the responses in lesions from patients prone and not prone to scar. British Journal of Dermatology. 2004; 150(1): 72–81. DOI: 10.1111/j.1365-2133.2004.05749.x
- Saint-Jean M., Khammari A., Jasson F. , Nguyen J.M., Dreno B. Different cutaneous innate immunity profiles in acne patients with and without atrophic scars. Eur J Dermatol. 2016; 26(1): 68–74. DOI: 10.1684/ejd.2015.2713
- Midgley A.C., Rogers M., Hallett M.B, Clayton A., Bowen T., Phillips A.O., Steadman R. Transforming growth factor-b1 (TGF-b1)-stimulated fibroblast to myofibroblast differentiation is mediated by hyaluronan (HA)-facilitated epidermal growth factor receptor (EGFR) and CD44 co-localization in lipid rafts. J Biol Chem. 2013; 288:14824–38. DOI: 10.1074/jbc.M113.451336
- Sato T., Kurihara H., Akimoto N., Noguchi N., Sasatsu M. Augmentation of gene expression and production of promatrix metalloproteinase 2 by Propionibacterium acnes-derived factors in hamster sebocytes and dermal fibroblasts: a possible mechanism for acne scarring. Biol. Pharm. Bull. 2011; 34(2): 295-9. DOI: 10.1248/bpb.34.295
- Pham C.H., Collier Z.J., Fang M., Howell A., Gillenwater T.J.The role of collagenase ointment in acute burns: a systematic review and meta-analysis. J Wound Care. 2019; 28(sup2): S9–S15. DOI: 10.12968/jowc.2019.28.Sup2.S9
- Sheets A.R., Demidova-Rice T.N., Shi L., Ronfard V., Grover K.V., Herman I.M. Identification and Characterization of Novel Matrix-Derived Bioactive Peptides: A Role for Collagenase from Santyl Ointment in Post-Debridement Wound Healing? PLoS One. 2016; 11(7). doi:10.1371/journal.pone.0159598.
- Часнойть А.Ч., Жилинский Е.В., Серебряков А.Е., Тимошок Н.Ю. Оценка противорубцовой эффективности препарата Ферменкол. Международные обзоры: клиническая практика и здоровье. 2016;1(19): 24–34.
- Майорова А.В., Сысуев Б.Б., Иванкова Ю.О., Ханалиева И.А. Коллагеназы в медицинской практике: современные средства на основе коллагеназы и перспективы их совершенствования. Фармация и фармакология. 2019;7(5):260-270. DOI: 10.19163/2307-9266-2019-7-5-260-270)
- Li Z.J., Kim S.M.. The Application of the Starfish Hatching Enzyme for the Improvement of Scar and Keloid Based on the Fibroblast-Populated Collagen Lattice. Applied Biochemistry and Biotechnology. 2014; 173, No4, P. 989–1002. DOI: 10.1007/s12010-014-0901-7
- Острецова М.Н., Снарская Е.С., Ткаченко С.Б., Алленова А.С. Особенности применения препарата гиалуронидазы для лечения и профилактики постакне. Российский журнал кожных и венерических болезней. 2017; 20(4): 209-213.
- Круглова Л.С., Грязева Н.В., Талыбова А.М. Симптомокомплекс постакне: методы профилактики и терапии. Клиническая дерматология и венерология. 2020;19(5):622‑629.
- Свечникова Е.В., Дубина Л.Х., Кожина К.В. Современные представления о постакне. Новые возможности коррекции. Медицинский альманах. 2018; 3(54): 137-140.
- Gozali M.V., Zhou B. Effective treatments of atrophic acne scars. J Clin Aesthet Dermatol. 2015; 8(5): 33-40. PMID: 26029333; PMCID: PMC4445894.
- Yang J.H., Yoon J.Y., Kwon H.H., Min S., Moon J., Suh D.H. Seeking new acne treatment from natural products, devices and synthetic drug discovery. Dermatoendocrinol. 2017; 9(1): e1356520. DOI:10.1080/19381980.2017.1356520
- Tan J. Acne and Scarring: Facing the Issue to Optimize Outcomes. J Drugs Dermatol. 2018; 17(12): s43. PMID: 30586480.
- Assessment of Prevalence, Knowledge, Attitude, and Psychosocial Impact of Acne Vulgaris among Medical Students in Saudi Arabia January 2017Journal of Clinical & Experimental Dermatology Research 08(04)
- Li D., Chen Q., Liu Y., Liu T., Tang W., Li S. The prevalence of acne in Mainland China: a systematic review and meta-analysis. BMJ Open. 2017; 7(4):e015354. doi: 10.1136/bmjopen-2016-015354.
- Rocha M.A., Bagatin E. Skin barrier and microbiome in acne. Arch Dermatol Res. 2018; 310(3): 181-185. doi: 10.1007/s00403-017-1795-3.
- Karimkhani C., Boyers L.N., Prescott L., Welch V., Delamere F.M., Nasser M., Zaveri A., Hay R.J., Vos T., Murray C.J., Margolis D.J., Hilton J., MacLehose H., Williams H.C., Dellavalle R.P. Global burden of skin disease as reflected in Cochrane Database of Systematic Reviews. JAMA Dermatol. 2014; 150(9): 945-51. doi: 10.1001/jamadermatol.2014.709.
- Moon J., Yoon J.Y., Yang J.H., Kwon H.H., Min S., Suh D.H. Atrophic acne scar: a process from altered metabolism of elastic fibres and collagen fibres based on transforming growth factor-β1 signalling. Br J Dermatol. 2019;181(6):1226-1237. doi: 10.1111/bjd.17851.
- Davis E.C., Callender V.D. A review of acne in ethnic skin: pathogenesis, clinical manifestations, and management strategies. J. Clin. Aesthet. Dermatol. 2010; 3(4): 24–38.
- Lauermann F.T., Larangeira de Almeida Jr. H., Duquia R.P., Martins de Souza P.R., Juliano de Avelar B. Acne scars in 18-year-old male adolescents: a population-based study of prevalence and associated factors. An Bras Dermatol. 2016; 91(3): 291–295. DOI: 10.1590/abd1806-4841.20164405

